Les êtres vivants ont besoin de nutriments pour fabriquer leur biomasse et pour fonctionner. Les stratégies alimentaires ne sont pas toutes les mêmes. Les plantes trouvent leurs nutriments sous forme dissoute dans l’eau du sol, et de là, les nutriments entrent dans la chaîne trophique. Cependant, à la toute base de la chaîne, il y a le sol. Non seulement il est capable de stocker les nutriments, mais en plus, il constitue un habitat pour des dizaines de milliers d’espèces. Dans le but d’optimiser leur accès aux nutriments, certaines espèces se sont alliées ingénieusement. Allons voir une de ces symbioses incroyable développée il y a déjà des millions d’années et dont nous nous inspirons même ! Cette symbiose n’a d’autre but que de fournir la plante en azote, cet élément si indispensable à la vie.
Rôle de l’azote
La structure des cellules, l’unité fondamentale de tous les êtres vivants, est majoritairement composée d’oxygène (O), de carbone (C) et d’hydrogène (H). Les cellules ont ensuite besoin d’énergie pour mettre en route les processus métaboliques impliqués dans la synthèse moléculaire. Les molécules impliquées dans le développement, le fonctionnement et la reproduction des organismes (ADN et ARN) et celles impliquées dans la libération d’énergie pour les cellules (AMP, ADP et ATP) sont notamment constituées de nucléotides. Ces unités de construction sont composées d’une base azotée. Aussi, les processus biologiques sont assurés par les protéines qui sont composées de chaînes d’acides aminés liés par des liaisons peptidiques. Chaque acide aminé est constitué d’un groupe amine composé d’azote. Ainsi, l’azote est un élément chimique primordial dans le monde vivant.
Pourtant… A privatif Zôt vivant, Azote privé de vie
Ce n’est pas pour rien si Antoine Lavoisier a choisi au 18e siècle le nom de Azote (du grec A privatif et Zôt vivant), qui signifie privé de vie, pour l’élément composant le gaz principal de l’atmosphère terrestre. En effet, 78% de l’atmosphère est composée de diazote (N2), ce qui fait de l’atmosphère le réservoir principal d’azote sur terre. Le diazote est relativement inerte du fait de sa grande stabilité induite par la triple liaison liant les deux atomes d’azote. Dans cet état il n’est donc pas vraiment disponible pour la plupart des vivants, ni pour les plantes, ni pour vous et moi. Comment la vie va-t-elle donc palier à ce problème?
Le cycle biogéochimique de l’azote
La biogéochimie étudie le comportement des éléments chimiques du système Terre. Ceux qui s’intéressent aux cycles biogéochimiques étudient le transfert, les transformations, les échanges de ces substances chimiques. Ils voudront savoir les différentes formes qu’un élément chimique (ou une molécule) peut prendre et en quelles quantités elles se trouvent. Ils voudront savoir comment se font les tranferts, transformations et/ou échanges, et donc chercheront à comprendre les processus physico-chimiques sous-jacents (Hedges, 1992).
Lorsque l’on s’intéresse au cycle biogéochimique de l’azote dans les sols, il apparaît rapidement que les bactéries sont au centre de son fonctionnement. En effet, certaines bactéries sont capables de fixer l’azote atmosphérique. C’est-à-dire qu’elles peuvent capter l’azote se trouvant sous forme de N2, le transformer en une forme plus assimilable et ainsi permettre son transfert dans les différentes molécules organiques créées par le vivant. L’azote, sous sa forme organique, peut arriver au sol lorsque les êtres vivants meurent, via les exudats racinaires ou via l’urine des animaux. Une fois dans le sol, toute une guilde de bactéries seront responsables de la transformation de cet azote en différentes formes, qui seront réassimilables par les plantes ou qui retourneront à l’atmosphère ou qui seront exportées par les eaux de ruissellement dans les eaux de surface ou souterraines (Fig. 1).
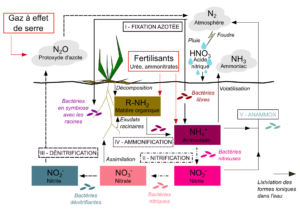
Figure 1: Cycle Biogéochimique de l’Azote dans les sols (par Nathalie Diaz, d’après Frontier et al., 2008 ; Gobat et al., 2010 ; Carné-Carnavalet, 2011)
Le principal réservoir d’azote se trouve dans l’atmosphère sous forme de diazote (N2). Lors d’orage, l’énergie de la foudre peut dissocier les molécules de diazote et une suite de réactions chimiques peut mener à la formation d’acide nitrique (HNO3) qui pourra être emmené au sol par les eaux de pluie. Il pourra alors être disponible pour les plantes sous forme de nitrates (NO3–). Le diazote peut aussi être fixé dans la matière organique par les bactéries fixatrices d’azote (il y a d’ailleurs dix fois plus d’azote qui entre dans le sol par ce biais que par la foudre, –> voir ici). Celles-ci sont soit libres, soit en symbiose avec les racines de certaines plantes. L’azote sera alors transféré dans la matière organique (symbolisé par R-NH2). Une fois au sol et via les processus d’ammonification, l’azote de la matière organique pourra se retrouver sous forme d’ammonium (NH4+). Depuis là, l’ammonium peut prendre différentes voies : (i) soit il passera sous forme d’ammoniac (NH3) et se volatilisera dans l’atmosphère, (ii) soit il sera utilisé par les bactéries de type Anammox et il retournera à l’atmosphère, (iii) soit il sera utilisé par les bactéries nitreuses, puis nitriques, et sera oxydé en nitrites (NO2–), puis nitrates (NO3–) ; c’est la nitrification, (iv) puis finalement, il peut aussi, dans certains cas, être disponible pour les plantes. Les nitrates (NO3–) peuvent être assimilées par les plantes ou retourner à l’atmosphère via les bactéries dénitrifiantes. Finalement, les formes d’azotes ammonium, nitrites, nitrates, peuvent être exportés (ou lixiviés) par les eaux de ruissellement dans les eaux souterraines ou de surface.
Des plantes qui appellent les bactéries à la rescousse
Les bactéries fixatrices d’azote peuvent soit être libres dans le sol, soit être en symbiose avec les racines de certaines plantes. La fixation d’azote est un processus qui demande beaucoup d’énergie. C’est pour cela qu’il est intéressant pour les bactéries de faire cette alliance. Pour initier une symbiose, les plantes vont entamer un véritable dialogue via des signaux chimiques pour attirer les bactéries fixatrices d’azote. Celles-ci vont répondre en sécrétant une protéine, qui activera une hormone au niveau de la racine des plantes, ce qui induira la formation des petits nodules racinaires capables d’accueillir les bactéries. Dans ce microenvironnement, les conditions nécessaires pour la fixation d’azote sont réunies. En échange de l’azote fixée par les bactéries alors disponible pour les plantes, ces dernières leur fournissent l’énergie nécessaire sous forme de carbohydrates (Gobat et al., 2010; Carné-Carnavalet, 2011).
Les plantes capables de faire ces symbioses sont les légumineuses (Fabacées), comme le trèfle, la luzerne, les haricots, etc, qui s’allient avec les bactéries de type rhizobium, ainsi qu’un grand nombre de plantes non-légumineuses, souvent des plantes ligneuses, comme l’aulne, qui s’allient avec des bactéries actinomycètes de type Frankia (Swenzen, 1996; Gobat et al., 2010; Carné-Carnavalet, 2011).

Figure 2: Nodules racinaires sur un trèfle (photos et montage, par Nathalie Diaz)
Des symbioses très anciennes
Récemment, Martin et al. (2017) ont fait une synthèse sur l’origine des symbioses entre les plantes et les microorganismes. Ces associations primitives se sont développées presque tout de suite après que les plantes aient colonisé la terre ferme, pendant l’Ordovicien il y a 443-470 millions d’années. La terre ferme était essentiellement minérale, ainsi, pour vivre dans un milieu si austère, les premières plantes colonisant les terres ont choisi des champignons, dits mycorrhiziens (de Myco champignion et Rhiza racine, pour les aider à se procurer les nutriments. Cette symbiose fonctionne tellement bien qu’aujourd’hui encore, près de trois quarts des espèces de plantes vasculaires font une symbiose avec des mycorrhizes. C’est plus tard, il y a environ 100 millions d’années, avec l’arrivée des angiospermes (plantes à fleurs), que les symbioses entre les bactéries fixatrices d’azote et les racines sont apparues.
L’azote et les humains
Le cycle de l’azote a été fortement modifié par les activités anthropiques notamment avec l’arrivée de l’utilisation des fertilisants azotés depuis le début des années 1900. Le procédé d’Haber-Bosch s’inspire des processus bactériens puisqu’il permet la transformation du diazote atmosphérique en ammonium. Mais comme pour les bactéries, cette réaction est très énergivore et aujourd’hui, 1 à 2% de l’énergie mondiale est dédiée à la production de fertilisants azotés. Ainsi, la fixation azotée a plus que doublé depuis les années 60, et ce, surtout en Asie avec la Révolution Verte. Aussi, la combustion des énergies fossiles amène à l’émission d’oxydes d’azote qui peuvent se retrouver au sol par l’acidification des pluies par l’acide nitrique (HNO3).
Ces surplus d’azote ont des impacts avérés, non seulement sur les écosystèmes au niveau des sols et de l’eau, mais aussi sur les traits génétiques des organismes eux-mêmes (Guignard et al., 2017). Souvent, les plantes les plus demandeuses en azote ont été sélectionnées par l’ajout de fertilisants. C’est donc un cercle vicieux et ces processus ont rendu l’agriculture dépendante des fertilisants. Ceci, engendre notamment un coût économique important pour les agriculteurs. Outre les impacts socio-économiques, un excès d’azote entraîne toute une série de dommages environnementaux. En effet, les formes d’azote dans le sol sont facilement mobilisables par l’eau . Ainsi, il a été observé, que dans certains cas, seul 10% de la totalité du fertilisant va réellement resté dans le sol (Gobat et al., 2010). Le reste va se retrouver dans l’eau. Cet excès peut engendrer une eutrophisation des milieux aquatiques. Ce qui signifie leur asphyxie par la perte d’oxygène dissout dans l’eau dû à l’augmentation de l’activité biologique du milieu, et mener donc à la perte de biodiversité mais aussi à la mise en danger de nos sources d’eau potable.
L’impact de l’agriculture sur la qualité des eaux est un problème bien réel mais qui a encore de nombreuses failles dû au manque de coordination au niveau suisse. L’OFEV (Office Fédéral de l’Environnement) cherche néanmoins à améliorer les mesures de contrôle grâce à la création d’une liste d’éléments à évaluer et à un manuel destiné aux autorités compétentes (–> voir ici).
Soit, dans une optique d’agriculture durable, il serait important de questionner l’utilisation des fertilisants. Sont-ils réellement indispensables? Il semble qu’ils amènent beaucoup de problèmes tant sociaux, qu’économiques, qu’environnementaux. Questionner leur utilisation semble donc fondé. Surtout que le monde vivant, si on lui laisse l’occasion d’utiliser son ingéniosité, a réglé cette question de l’azote il y a des millions d’années déjà…
Références:
Carné-Carnavalet, C., 2011. Agriculture Biologique, une approche scientifique. Editions France-Agricole, France.
Frontier, S., Pichod-Viale, D., Leprêtre, A., Davoult, D., Luczak, C., 2008. Ecosystèmes, Structure, Fonctionnement, Evolution. Editions Dunod, France.
Gobat et al., 2010. Le sol vivant. Bases de pédologie – Biologie des sols. Presses polytechniques et universitaires romandes, Lausanne.
Guignard, M. S., , Leitch, A. R., Acquisti, C., Eizaguirre, C., Elser, J. J., Hessen, D. O., Jeyasingh, P. D., Neiman, M., Richardson, A. E., Soltis, P. S., Soltis, D. E., Stevens C. J., Trimmer, M., Weider, L. J., Woodward, G., and Leitch, I. J., 2017. Impacts of Nitrogen and Phosphorus: From Genomes to Natural Ecosystems and Agriculture. Frontiers in Ecology and Evolution, 5: 70, doi: 10.3389/fevo.2017.00070
Hedges, J. I., 1992. Global biogeochemical cycles: progess and problems. Marine Chemistry, 39, 67-93.
Martin, F., Uroz, S., Barker, D. G., 2017. Ancestral alliances: Plant mutualistic symbioses with fungi and bacteria. Science, 356, 819, DOI: 10.1126/science.aad4501
Swensen, S. M., 1996. The Evolution of Actinorhizal Symbioses: Evidence for Multiple Origins of the Symbiotic Association. American Journal of Botanny, 83, 1503-1512.















